为进一步优化监管服务水平,督促企业落实主体责任,促进医疗器械产业创新发展,省药监局医疗器械处联合海口国家高新区药械创新服务站整理了业界较为关注的问题,自
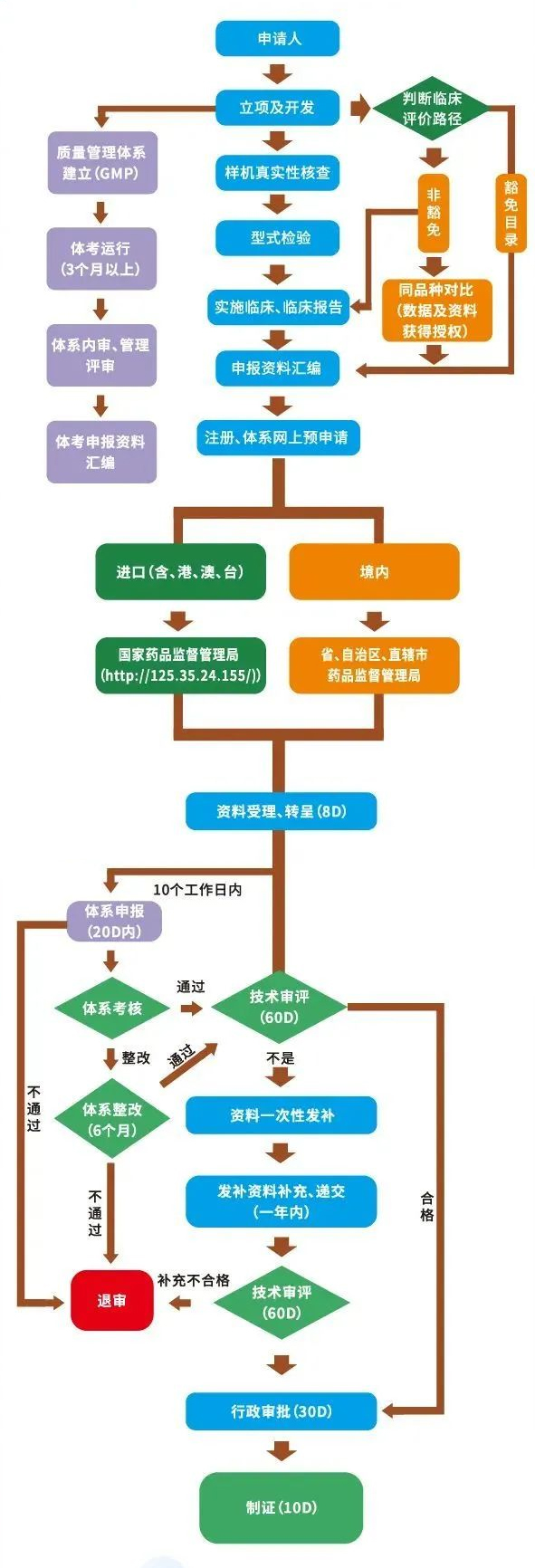
注:申请第二类医疗器械产品注册,注册申请人应当对所在地省、自治区、直辖市人民政府药监管理部门提交注册申请资料。
申请第三类医疗器械产品注册,注册申请人应当向国务院药监管理部门提交注册申请资料。
向我国境内出口第二类、第三类医疗器械的境外注册申请人,由其指定的我国境内企业法人向国务院药监管理部门提交注册申请资料和注册申请人所在国(地区)主管部门准许该医疗器械上市销售的证明文件。未在境外上市的创新医疗器械,可以不提交注册申请人所在国(地区)主管部门准许该医疗器械上市销售的证明文件。
A:1.申报注册的产品已经列入《医疗器械分类目录》,且管理类别为第二类(注:对新研制的尚未列入分类目录的医疗器械,申请的人能直接向国家药监局申请第三类医疗器械产品注册,也可以依据分类规则判断产品类别并向国家药监局申请类别确认后,申请产品注册或者办理产品备案)。
4.办理医疗器械注册事务的人员应当拥有相对应的专业相关知识,熟悉医疗器械注册或者备案管理的法律、法规、规章和技术方面的要求,如:《医疗器械监督管理条例》《医疗器械注册管理办法》《医疗器械分类规则》《关于进一步做好医疗器械产品分类界定工作的通知》《关于发布医疗器械产品技术方面的要求编写指导原则的通告》《医疗器械临床试验规定》《医疗器械临床评价技术指导原则》《医疗器械说明书和标签管理规定》等。
5.申请人申请注册,应当遵循医疗器械安全有效基础要求,保证研制过程规范,所有数据真实、完整和可溯源。
6.申请注册的资料应当使用中文。根据外文资料翻译的,应当同时提供原文;引用未公开发表的文献资料时,应当提供资料所有者许可使用的证明文件;申请人对资料的真实性负责。
A:医疗器械注册人、备案人委托具备相应条件的公司制作医疗器械时,在开展正式的委托生产活动前,应与受托生产企业依据《医疗器械委托生产质量协议编制指南》签订《医疗器械委托生产质量协议》,明确双方在产品质量实现的全过程中各自应当承担的权利、义务和责任,形成完善的医疗器械质量管理体系,确保《医疗器械生产质量管理规范》的各项要求得到一定效果落实。
根据《医疗器械监督管理条例》的规定,医疗器械注册人、备案人、受托生产企业依据《医疗器械生产质量管理规范》及相关附录的要求,开展医疗器械生产质量管理体系年度自查工作,编写并上报质量管理体系年度自查报告。
A:医疗器械注册人、备案人能自行销售,也能委托医疗器械经营企业销售其注册、备案的医疗器械。医疗器械注册人、备案人在其住所或者生产地址销售其注册、备案的医疗器械可免于经营许可或者备案。